Entrevista Dr. Sergio Lavandero: “El camino de la ciencia Chilena por entender la Autofagia”
El concepto de autofagia ha ido tomando una relevancia sustantiva en los últimos años, más aún, durante este 2016, cuando el Premio Nobel de Medicina, recayó en el científico japonés Yoshinori Ohsumi (Fukuoka, 1945), galardonado por sus aportes vinculados a los mecanismos moleculares que regulan este proceso.
Centenares de científicos alrededor del mundo se mostraron gratamente sorprendidos por la noticia del Nobel de Medicina 2016, el cual genera un gran interés por este mecanismo fisiológico. Produciendo un impacto generalizado en la comunidad científica, la cual –cada vez más– incorpora investigadores que se aboquen a estudiar la autofagia.

En nuestro país –y desde el año 2002– el Dr. Sergio Lavandero, Director del Advanced Center for Chronic Diseases (ACCDiS) –Centro de excelencia nacional formado por la Universidad de Chile y la Pontifica Universidad Católica de Chile junto al apoyo del Programa FONDAP de CONICYT, y que tiene como objetivo identificar los elementos comunes de las enfermedades cardiovasculares y cáncer, para ofrecer alternativas de prevención o control del daño causado por ellas en nuestra población– ha realizado basta investigación sobre autofagia, por lo cual, este hito, marca el inicio de una nueva y promisoria era de investigación. Ya que, en palabras de distintos medios de comunicación, y la propia comunidad científica, “los descubrimientos de Ohsumi condujeron a un nuevo paradigma en nuestra comprensión sobre cómo la célula recicla su contenido”.
 El Dr. Sergio Lavandero es un destacado científico chileno, reconocido por su alta calidad investigativa y efectiva productividad. Lo que se resume, en 218 publicaciones a su haber, siendo citado en más de 11.027 ocasiones según Google Scholar, lo que se considera importante en cualquier campo de las ciencias. Tiene 42 publicaciones en el área de autofagia, tópico central de esta crónica.
El Dr. Sergio Lavandero es un destacado científico chileno, reconocido por su alta calidad investigativa y efectiva productividad. Lo que se resume, en 218 publicaciones a su haber, siendo citado en más de 11.027 ocasiones según Google Scholar, lo que se considera importante en cualquier campo de las ciencias. Tiene 42 publicaciones en el área de autofagia, tópico central de esta crónica.
Actualmente es Profesor Titular de la Facultad de Ciencias Químicas y Farmacéuticas, y de la Facultad de Medicina, Universidad de Chile. También es Profesor Adjunto en la División de Cardiología, University of Texas Southwestern Medical Center (Dallas, Texas). Durante su carrera, el Dr. Lavandero ha sido Presidente e integrante del Consejo Superior de Ciencia de Fondecyt, Presidente de la Sociedad Chilena de Bioquímica y Biología Molecular e integrante del Consejo de Evaluación y Vicerrector de Investigación de la Universidad de Chile. El Prof. Lavandero también es miembro correspondiente de la Academia Chilena de Ciencias.
Él integra los comités editoriales de las revistas Circulation, American Journal of Physiology Endocrinology & Metabolism, Cell Death & Diseases y BBA Molecular Basis of Diseases, también ha sido revisor ad hoc de prestigiosas revistas internacionales y de agencias nacionales e internacionales que apoyan la investigación científica.
A continuación, la entrevista que la Sociedad de Biología de Chile, realizó al Dr. Sergio Lavandero.
¿Qué se entiende por autofagia?
La autofagia es un mecanismo de degradación celular que permite la remoción de proteínas y organelos tanto normales como alterados. El nombre autofagia (etimológicamente significa “comerse a sí mismo”) y fue acuñado por el Premio Nobel Dr. Christian de Duve (1974).
La autofagia basal es un mecanismo homeostático de limpieza y reciclamiento que opera al interior de todas nuestras células. Sin embargo, ella se puede activar o inhibir por sobre este nivel basal en respuesta a diversas condiciones de estrés. La autofagia es un proceso programado, secuencial y dinámico, caracterizado por la presencia de vacuolas de doble membranas en el citoplasma celular.
¿Cómo se ha desarrollado la historia de la autofagia?
Se inició en 1955 con el descubrimiento de los lisosomas por el Dr. Christian de Duve, y su posterior descripción de las “vacuolas autofágicas” en el año 1963. Luego, se estableció que el ayuno induce autofagia en el hígado y que tanto la privación de aminoácidos como el glucagón, son las señales primarias responsables del citado efecto. Luego de esta etapa, inicialmente descriptiva y morfológica, se pasó aun largo período de silencio, hasta que en 1980, se comenzó a entender los mecanismos moleculares de cómo se forman y terminan las vacuolas autofágicas.
Se estableció que la autofagia es un proceso muy dinámico que se puede subdividir en cuatro etapas: iniciación, elongación, cierre y fusión, y finalmente, degradación. Simultáneamente, a medida que la vacuola se forma (autofagosoma), va capturando el material a degradar. El proceso continúa a formación del autofagolisoma (o también conocido como autolisosoma), fusión del autofagosoma con un lisosoma, compartimento donde se ejecuta la degradación gracias a la acción de las enzimas lisosomales y pH ácido (ver Figura 1).
El trabajo silencioso del Dr. Otsumi, estudiando el proceso autofágico en levadura, fue clave para identificar y caracterizar las proteínas ATG que participan y regulan las cuatro etapas claves. A través de mutantes de levaduras, el Dr. Otsumi descubrió los genes básicos que codifican para estas proteínas reguladoras esenciales del proceso autofágico. El Dr. Otsumi también tuvo otro mérito, a través estos trabajos en autofagia, formó a generaciones de jóvenes científicos japoneses sobresalientes que han continuado su legado.
¿Cómo estas investigaciones han contribuido a un mayor conocimiento y potenciales aplicaciones?
El equipo de científicos japoneses, liderado por el Dr. Ohsumi creó un ratón transgénico “sensor de la autofagia” que expresa una proteína recombinante artificial formada por la proteína Atg8 (o LC3) unida a la proteína fluorescente verde (GFP)en todas sus células. El ayuno hasta por 48 h de estos animales incrementó el aumento de número de vacuolas autofágicas LC3-GFP positivas en distintos órganos (hígado, riñón, corazón, diafragma, músculos esqueléticos, etc.) en relación a sus controles, alcanzando máximos en distintas magnitudes a las 24 ó 48 horas post-ayuno. Sorprendentemente, tanto el corazón como algunos músculos fueron los órganos que más experimentaron autofagia. Luego estos investigadores se preguntaron ¿Cuándo experimentamos el máximo ayuno fisiológico? Esta interrogante, se respondió analizando la autofagia antes y durante el parto, así como durante las primeras horas post-nacimiento en los distintos tejidos de ratones que sobre-expresan la proteína LC3-GFP.
Antes del nacimiento, todos los requerimientos son provistos por la madre al feto a través del cordón umbilical. Sin embargo, esta situación cambia abruptamente cuando se corta este cordón al momento del nacimiento. Además, normalmente el recién nacido no recibe leche materna hasta después de 24 ó 48 horas posterior al nacimiento. Tampoco nuestras reservas de grasas son precisamente abundantes, por lo que existía el enigma de ¿Cómo sobrevivimos esta etapa crítica de estrés nutricional?
En ese camino, los Dres. Otsumi y Nizushima descubrieron que el corazón y varios músculos esqueléticos experimentan una intensa y transitoria activación del proceso autofagia que proporciona sustratos energéticos al recién nacido (Nature. 2004; 432:1032-6).
¿Se desregula la autofagia?
Si por cierto. Tanto la sobreactivación como ausencia de la autofagia se asocia al desarrollo de diversas patologías como cáncer, enfermedades neurodegenerativas, enfermedades cardiovasculares, entre otras. En el caso del infarto del miocardio, los cardiomiocitos experimentan estrés nutricional grave debido a la isquemia (falta de irrigación sanguínea) generado por una placa de ateroma o un trombo. En este caso, la autofagia se activa y cumple una función protectora, proporcionando energía a aquellos cardiomiocitos bajo estrés. Si se bloquea genética o farmacológicamente la activación de la autofagia, la función cardiaca se deteriora. Por otra parte, la hipertensión arterial es una enfermedad que afecta al 30% de los chilenos y a medida que se envejece su prevalencia se incrementa en forma notable. Hoy sabemos que la autofagia se activa en el corazón del hipertenso. En este caso su activación es dañina y media el proceso patológico. En este escenario, su bloqueo genético o farmacológico previene el deterioro de la función contráctil cardiaca. Hoy en día, sabemos que la autofagia tiene un comportamiento dual. El Janus de la mitología romana, dios de las puertas, los comienzos y los finales, un dios representado con dos caras.
Para mayor información acerca del papel de la autofagia en el sistema cardiovascular los refiero a los artículos de revisión: Lavandero et al. “Cardiovascular autophagy: concepts, controversies, and perspectives”. Autophagy. 2013; 9:1455-66 y Lavandero et al.“Autophagy in cardiovascular biology”.J ClinInvest. 2015; 125:55-64.
¿Qué medicamentos regulan la autofagia?
Varios, pero por lejos, rapamicinaes es el más conocido. Este medicamento inmunosupresor generado como un producto de la bacteria Streptomyceshygroscopicus, descubierta en el año 1965 en una muestra de suelo de la Isla de Pascua («Rapa Nui»), es un activador de la autofagia al inhibir un componente del complejo mTORC1. Este complejo tiene actividad proteína kinasa, por lo que su acción se explica por la fosforilación de proteínas ATG específicas y su correspondiente inhibición. Tanto rapamicina como la privación de aminoácidos, comparten el mecanismo de acción en relación a la autofagia. Por otra parte, la cloroquina, medicamento antimalárico, es un inhibidor de la autofagia al bloquear la etapa final del proceso. Sin embargo, existe una larga lista de otros compuestos químicos conocidos y otros en fase de desarrollo que regulan positiva o negativamente el proceso autofágico.
¿Qué investigaciones realiza ACCDiS en autofagia?
ACCDiS investiga dos enfermedades crónicas: cáncer y enfermedades cardiovasculares. Ambas son las enfermedades de mayor relevancia en Chile por su morbi-mortalidad. De hecho dan cuenta de casi el 60% de la mortalidad total en Chile. Al interior del centro, hay un grupo importante de científicos que trabajan en el tema de la autofagia y su vinculación con la génesis y desarrollo de las enfermedades antes mencionadas. Uno de estos investigadores, es el Dr. Alfredo Criollo, investigador asociado de ACCDiS y académico de la Facultad de Odontología de la Universidad de Chile.
El Dr. Criollo cuenta con 36 publicaciones en este tema, en revistas de alto impacto. Se formó en esta área junto a los Dres. Guido Kroemer (Francia) y Joseph Hill (USA). El Dr. Criollo está organizando el ICGEB Workshop «Autophagy: Physiological and Pathological Roles” que se realizará entre 23-24 Noviembre, 2016 en el Aula Magna de la Facultad de Ciencias Químicas & Farmacéuticas, Universidad de Chile.
Por otra parte, existe un evidente interés del tema de autofagia en Chile reflejado en el número de investigadores con líneas de investigación originales en autofagia tanto en Santiago como a lo largo de nuestro país.
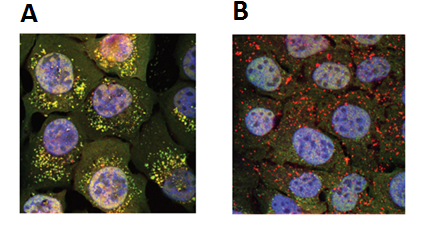
Figura 1. Curso temporal de la autofagia en células de cáncer óseo (U2OS). Las fotografías corresponden a células U2OS transfectadas con el plasmidio RFP-GFP-LC3 y expuestas a estrés nutricional para evaluar flujo autofágico. Paneles A y B muestran presencia de vacuolas amarillas y rojas, las cuales corresponden a autofagosomas y autolisosomas, respectivamente. Fotografías del Laboratorio del Dr. Alfredo Criollo.
Fuente: 4ID/CONGRESS, Todos los derechos reservados. ®
Periodista: Patricio Grunert Alarcón. ®
Para ser reproducida rogamos contactar a: support@4id.cl
Citar como fuente a: 4ID/CONGRESS ® / Patricio Grunert Alarcón, Todos los derechos reservados. ®

